Liofilizowany lizat Escherichia coli do stosowania w immunoprofilaktyce nawracających zakażeń układu moczowego (nZUM) u kobiet wg wytycznych polskich towarzystw naukowych1-3
Immunoprofilaktyka rekomendowana w nawracających zakażeniach układu moczowego przed profilaktyką antybiotykową1-3

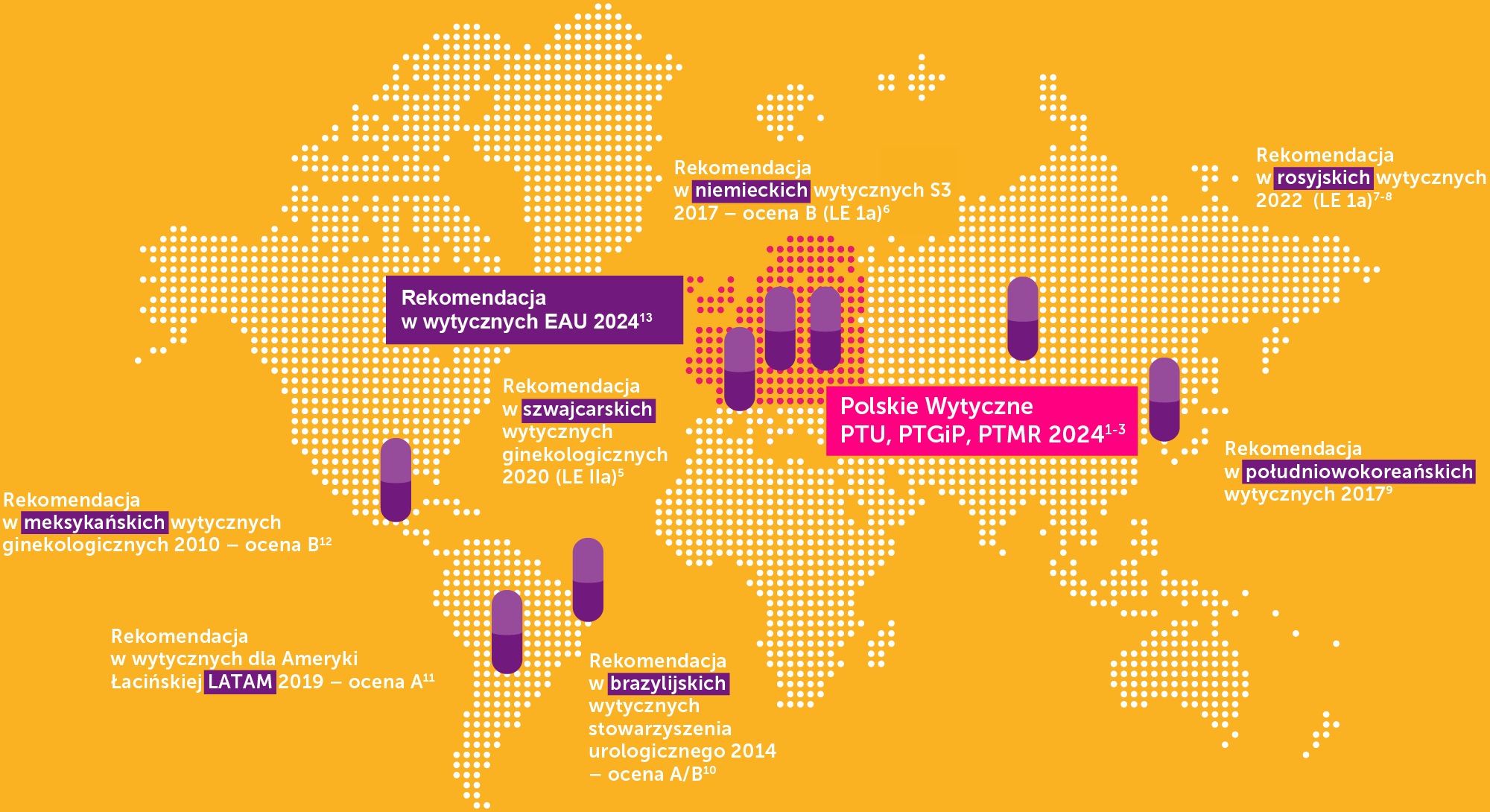
Międzynarodowe wytyczne zalecają profilaktykę z zastosowaniem OM‑894

Leczenie antybiotykami ostrego epizodu ZUM1-3
Wytyczne Towarzystw Naukowych (PTU, PTGiP, PTMR) dotyczące diagnostyki, terapii i postępowania w pozaszpitalnych zakażeniach dolnych dróg moczowych, 2024
Wybór antybiotyku powinien wynikać z analizy poziomu lekooporności. W leczeniu ZUM stosujemy na początku antybiotyk I rzutu, o niskiej lekooporności i wysokiej skuteczności.
Fosfomycyna (trometamol) – 3 g, pojedyncza dawka doustna;
Piwmecylinam – 400 mg 3 razy dziennie przez 3–5 dni;
Furazydyna – 100 mg 4 razy dziennie (1. dzień) i 100 mg 3 razy dziennie (kolejnych 6–9 dni);
Nitroksolina – 250 mg 3 razy dziennie przez 5 dni
| Antybiotyki I rzutu |
|
| Alternatywnie |
|
piwmecylinam oraz trometamol fosfomycyny
| Antybiotyki I rzutu |
|
| Antybiotyki II rzutu |
|
Profilaktyka nieantybiotykowa1-3
| Rodzaj profilaktyki | Dowody naukowe |
| Immunoprofilaktyka | Skuteczność liofilizowanego lizatu E. coli w ograniczaniu ryzyka nawrotów ZUM u kobiet potwierdzono w badaniu randomizowanym* |
| Dopochwowe estrogeny | Dopochwowa aplikacja niskich dawek estrogenów ogranicza ryzyko nZUM u kobiet po menopauzie |
| Produkty pochodzenia roślinnego, żurawina, D‑mannoza**, zakwaszenie moczu, probiotyki***, dopęcherzowe wlewki kwasu hialuronowego czy siarczanu chondroityny | Niska jakość dowodów |
Profilaktyka antybiotykowa1-3
Wytyczne Towarzystw Naukowych (PTU, PTGiP, PTMR) dotyczące diagnostyki, terapii i postępowania w pozaszpitalnych zakażeniach dolnych dróg moczowych, 2024
Trimetoprim – 100 mg raz na dobę;
Cefaleksynę – 125 mg lub 250 mg(niedostępna w Polsce);
Cefaklor – 250 mg raz na dobę;
Furazydynę – 50 mg raz na dobę (nie ma wiarygodnych danych klinicznych potwierdzających skuteczność).
Cefaleksynę – 250 mg (niedostępna w Polsce);
Cefaklor – 250 mg;
Furazydynę – 50 mg (nie ma wiarygodnych danych klinicznych potwierdzających skuteczność).
1. Juszczak K, Dybowski B, Holecki M, Hryniewicz W, Klimek H, Kłoda K, Sieroszewski P, Drewa T. Wytyczne Towarzystw Naukowych (PTU, PTGiP, PTMR) dotyczące diagnostyki, terapii i postępowania w pozaszpitalnych zakażeniach dolnych dróg moczowych. Przegląd Urologiczny 2024; 2(142):14-35. 2. Juszczak K, Dybowski B, Holecki M, Hryniewicz W, Klimek H, Kłoda K, Sieroszewski P, Drewa T. Wytyczne Polskiego Towarzystwa Urologicznego, Polskiego Towarzystwa Ginekologów i Położników oraz Polskiego Towarzystwa Medycyny Rodzinnej dotyczące diagnostyki, terapii i postępowania w pozaszpitalnych zakażeniach dolnych dróg moczowych. Ginekologia i Perinatologia Praktyczna 2024; 2(9):133-153. 3. Juszczak K, Dybowski B, Holecki M, Hryniewicz W, Klimek H, Kłoda K, Sieroszewski P, Drewa T. Wytyczne Towarzystw Naukowych (PTU, PTGiP, PTMR) dotyczące diagnostyki, terapii i postępowania w pozaszpitalnych zakażeniach dolnych dróg moczowych. Lekarz POZ 2024; 10:127-148.
Rekomendowany schemat postępowania przy nZUM1-3
Polskie Wytyczne PTU, PTMR, PTGiP zalecają następujący przebieg leczenia i zapobiegania ZUM1-3:
Unikanie czynników ryzyka
2.

3.
Profilaktyka antybiotykowa
Zaskoczony?
lekarzy chce rekomendować swoim pacjentom profilaktykę13
Źródło: Wagenlehner F et al. Social and economic burden of recurrent urinary tract infections and quality of life: a patient web-based study (GESPRIT). Expert Rev Pharmacoecon Outcomes Res. 2018;18(1):107-117.
Nie daj się zaskoczyć!
Większość objawów obserwowanych u pacjentów z ostrym niepowikłanym zapaleniem pęcherza jest typowa, ale niespecyficzna
Aby zmniejszyć zachorowalność, wybierz najlepszą opcję leczenia i ogranicz nawroty i/lub powikłania.
Kwestionariusz ACSS (The Acute Cystitis Symptom Score) wspiera pacjenta w samodiagnozie. Służy do:
- oceny nasilenia objawów u kobiet z objawowymi zakażeniami dolnych dróg moczowych i ich wpływu na jakość życia;
- różnicowania z innymi zaburzeniami układu moczowo-płciowego;
- oceny stopnia zaawansowania infekcji i wpływu na jakość życia;
- monitorowania skuteczności leczenia.
Niektórzy pacjenci są obciążeni wyższym ryzykiem nawrotów zakażeń układu moczowego
- aktywność seksualna (np. liczba partnerów seksualnych),
- zakażenia patogenami Gram-ujemnymi,
- zaburzenia czynności jelit (np. zaparcia),
- wcześniejsze leczenie bezobjawowej bakteriurii (ABU).
Nomogram LUTIRE został opracowany w celu oceny indywidualnego ryzyka nawrotu zakażenia w ciągu 12 miesięcy.
Uwzględnia on kluczowe czynniki ryzyka, takie jak:
- liczba partnerów seksualnych,
- zaburzenia czynności jelit,
- rodzaj wykrytych drobnoustrojów,
- stan hormonalny (np. menopauza),
- liczba wcześniejszych epizodów ZUM,
- przebyte leczenie bezobjawowej bakteriurii (ABU).
Działania niepożądane związane ze stosowaniem antybiotyków14
Naukowcy zwracają uwagę, że w erze, w której „superbakterie” stają się rzeczywistością, a narastająca oporność na antybiotyki znacznie przewyższa produkcję nowych antybiotyków, kluczowe staje się racjonalne gospodarowanie antybiotykami16.
Zwiększone ryzyko rozwoju ostrego uszkodzenia nerek (AKI) u pacjentów z ZUM17
- Powikłane nZUM mogą wiązać się z sepsą i powodować nagłe pogorszenie czynności nerek.
- Posocznica jest jednym z najczęstszych czynników wywołujących AKI.
- U 60% pacjentów z wstrząsem septycznym dochodzi do ostrego uszkodzenia nerek.
- Ostre uszkodzenie nerek wiąże się z dłuższą hospitalizacją i wysoką śmiertelnością.
Jakie są czynniki ryzyka rozwoju AKI u pacjentów z ZUM?
- Cukrzyca
- ZUM górnego odcinka dróg moczowych
- Wstrząs septyczny podczas hospitalizacji
- Zaburzona wyjściowa czynność nerek
Lekarze powinni zwrócić szczególną uwagę na pacjentów z ZUM zagrożonych AKI.
Rezerwuary bakterii i ich wpływ na nawroty ZUM18-20
Głównymi rezerwuarami chorób układu moczowo-płciowego są pochwa i jelita, ale rezerwuary można znaleźć również w cewce moczowej. W przypadku ZUM wywołanych przez uropatogenną E. coli (UPEC) ponad 60% nawrotów można przypisać pierwotnemu szczepowi infekującemu.
Co łączy środki przeciwdrobnoustrojowe z rezerwuarami bakterii i nawracającymi zakażeniami dróg moczowych?
- Zmniejszenie liczby Lactobacilli wytwarzających nadtlenek wodoru może predysponować chorobotwórcze bakterie jelitowe do zwiększonej kolonizacji
- Tworzenie wewnątrzkomórkowych społeczności bakteryjnych niewrażliwych na antybiotyki
- Zmiana bariery glikozaminoglikanowej urotelium, co może zwiększać podatność osobnika na infekcje szczepami enteropatogennymi.
Upośledzenie mikrobiomu
Niedawno zidentyfikowano rezydujące drobnoustroje w drogach moczowych człowieka, składające się z wielu rodzajów i gatunków, takich jak Lactobacillus crispatus. Gatunki komensalne w drogach moczowych i moczowo-płciowych, które są częścią lokalnej mikrobioty, mogą chronić przed kolonizacją uropatogenami.
Zarówno sama infekcja, jak i strategie leczenia, takie jak terapia przeciwdrobnoustrojowa, mogą zaburzać mikrobiom układu moczowego i wpływać na lokalną homeostazę immunologiczną oraz ogólny stan zdrowia.
Opcje diagnostyczne, prognostyczne i terapeutyczne w leczeniu ZUM mogą wkrótce obejmować wysiłki mające na celu pomiar, przywrócenie i/lub zachowanie natywnej, zdrowej ekologii mikroflory układu moczowego.
Źródło: https://recap-cystitis.com/hcp/red-flags
1. Juszczak K., Dybowski B., Holecki M., Hryniewicz W., Klimek H., Kłoda K., Sieroszewski P., Drewa T.: Wytyczne Towarzystw Naukowych (PTU, PTGiP, PTMR) dotyczące diagnostyki, terapii i postępowania w pozaszpitalnych zakażeniach dolnych dróg moczowych. Przegląd Urologiczny 2024/2 (tom 142), 14-35.
2. Juszczak K., Dybowski B., Holecki M., Hryniewicz W., Klimek H., Kłoda K., Sieroszewski P., Drewa T.: Wytyczne Polskiego Towarzystwa Urologicznego, Polskiego Towarzystwa Ginekologów i Położników oraz Polskiego Towarzystwa Medycyny Rodzinnej dotyczące diagnostyki, terapii i postępowania w pozaszpitalnych zakażeniach dolnych dróg moczowych. Ginekologia i Perinatologia Praktyczna 2024/2 (tom 9), 133-153.
3. Juszczak K., Dybowski B., Holecki M., Hryniewicz W., Klimek H., Kłoda K., Sieroszewski P., Drewa T.: Wytyczne Towarzystw Naukowych (PTU, PTGiP, PTMR) dotyczące diagnostyki, terapii i postępowania w pozaszpitalnych zakażeniach dolnych dróg moczowych. Lekarz POZ 2024/10, 127-148.
4. Gołąbek T, Lipiński M, Drewa T i wsp. Zalecenia zespołu ekspertów dotyczące leczenia i profilaktyki zakażeń układu moczowego immunostymulatorem Uro-Vaxom (OM-89). Przegl Urol 2017; 2:24-29.
5. Betschart C i wsp. Guidelines of the Swiss Society of Gynecology and Obstetrics (SSGO) on acute and rUTIs in women including pregnancy. Swiss Medical Weekly 2020l;4: 150.
6. Leitlinien AWMF-Register-Nr.043044, 2017. German Guidelines. https://www.awmf.org/uploads/tx_szleitlinien/043-044k_S3_Harnwegsinfektionen_2017-05.pdf (Dostęp: 11.2023).
7. Perepanova TS, Kozlov RS, Rudnov VA, Sinyakova LA, Palagin IS. Federal Clinical Guidelines for Antimicrobial Therapy and Prevention of Infections of the Kidney, Urinary Tract, and Male Genitals. Ter Arkh. 2016;88(4):100-104.
8. Perepanova TS., Sinyakova LA., Lokshin KL. Cystitis in women. Clinical recommenda- tions. Approved by the Ministry of Health of Russia, 2021, s. 36.
9. Lee SJ i wsp. Guidelines of The KAUTI and Inflammation: Recurrent UTI. Urogenit Tract Infect 2017; 12:7–14.
10. Brazilian Uro Society. https://www.portaldaurologia.org.br/medicos/wp-content/uploads/2015/09/infeccao_urinaria_de_repeticao.pdf (Dostęp: 11.2023).
11. Haddad JM i wsp. LATAM consensus on uncomplicated rUTI. Int Urogynecol J. 2019; 31:35–44.
12. Colegio Mexicano de Especialistas em Ginecologia y Obstetricia. Ginecol Obstet Mex. 2010; 78:437–459.
13. Wagenlehner F i wsp. Social and economic burden of recurrent urinary tract infections and quality of life: a patient web-based study (GESPRIT). Expert Rev Pharmacoecon Outcomes Res. 2018; 18(1):107-117.
14. NICE Guidance. Urinary tract infection (recurrent): antimicrobial prescribing. 2018. Available from: https://www.nice.org.uk/guidance/ng112/resources/urinary-tract-infection-recurrent-antimicrobial-prescribing-pdf-66141595059397 (dostęp: 03.2025).
15. NICE Gudelines. 2018. www.nice.org.uk/guidance/ng112/resources/urinary-tract-infectionrecurrent-antimicrobial-prescribingpdf-66141595059397 (dostęp: 1.04.2025).
16. Brodie A. Retrospective Study of Immunotherapy Treatment with Uro-Vaxom (OM-89®) for Prophylaxis of Recurrent Urinary Tract Infections. Curr Urol. 2020;14(3):130-134.
17. Hsiao CY i wsp. Risk Factors for Development of Acute Kidney Injury in Patients with Urinary Tract Infection. PLoS One 2015; 10(7):e0133835.
18. Forde BM i wsp. Population dynamics of an Escherichia coli ST131 lineage during recurrent urinary tract infection. Nat Commun 2019; 10(1):3643.
19. Anderson GG i wsp. Intracellular bacterial biofilm-like pods in urinary tract infections. Science 2003; 301(5629):105-107.
20. Neugent ML i wsp. Microbiome and Its Potential Role in Urinary Tract Infection. mBio 2020; 11(2):e00218-20.